20. Juli 2021
Sehr geehrte Kolleginnen und Kollegen,
ab dem 20. Juli 2021 werden wir die vereinheitlichte Nomenklatur für lymphatische Zellen des peripheren Blutes anwenden. Sie basiert auf der Empfehlung vom »Arbeitskreis Labor der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO)«. Grundsätzliche Punkte der neuen Nomenklatur:
- Bei der Erstellung des mikroskopischen Differenzial-Blutbildes erfolgt eine Unterscheidung der Lymphozyten aufgrund rein morphologischer
Charakteristika zwischen typischen und atypischen Lymphozyten. Unter die Kategorie typisch fallen Standard-Lymphozyten und LGL-Zellen (large granular lymphocytes) sofern sie weniger als 10% der Gesamtleukozyten ausmachen. - Die atypischen Lymphozyten werden kategorisiert in »atypisch, vermutlich reaktiv« oder »atypisch, vermutlich neoplastisch«. Sofern möglich, erfolgt eine kommentierende Beschreibung anerkannter, zytologisch definierter Lymphozyten- Typen.
- Der Kategorie »Diverse« werden alle die Zellen zugeordnet, die bisher noch keiner Gruppe angehören. Das betrifft sowohl normale, jedoch im peripheren Blut selten bis gar nicht anzutreffende lymphatische Zellen, wie z. B. Plasmazellen, als auch atypische lymphatische Zellen unklarer Dignität und LGL-Zellen, wenn sie über 10% der Gesamtleukozyten ausmachen. Eine Beschreibung der Zellen erfolgt, sofern dies zuverlässig möglich ist.
- Kernschatten werden als eigene Gruppe aufgeführt. Da sie sowohl bei Infekten als auch bei Lymphomen (bes. CLL) oder bei akuten Leukämien auftreten und keine Diagnose erlauben, entfällt die vorangestellte Bezeichnung »Gumprecht«, da sie die Diagnose einer CLL suggeriert.
- Erythroblasten, bisher Normoblasten, werden, sofern sie auftreten, absolut auf 100 Leukozyten bezogen, erfasst.
- Die Lymphomzellen der CLL erscheinen im Ausstrich in der Regel als morphologisch typische Lymphozyten und werden nicht getrennt aufgeführt. Ihre Einstufung als pathologisch erfolgt allein aufgrund der signifikanten Erhöhung.
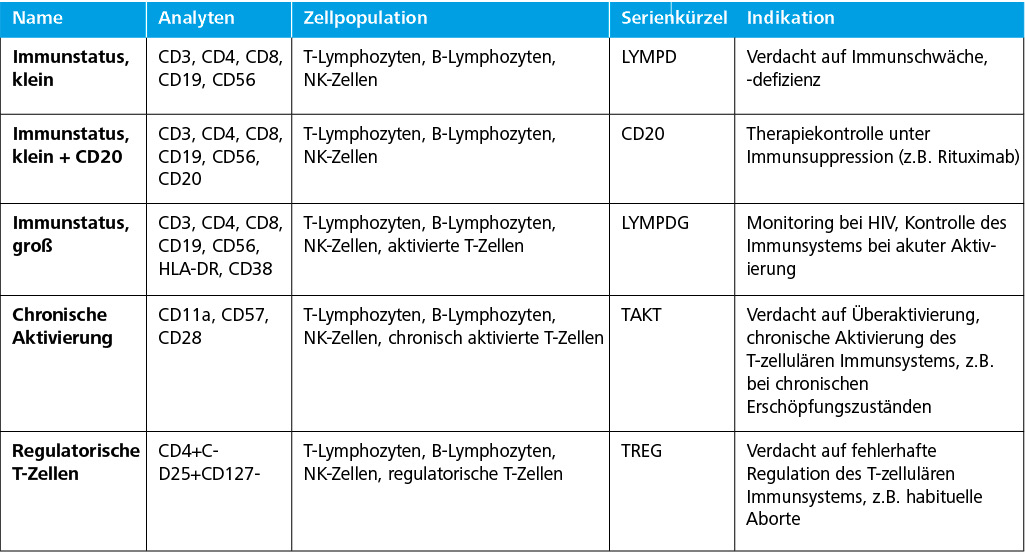
Im Rahmen der Umstellung der Lymphozyten-Nomenklatur werden zusätzlich die Normwerte des mikroskopischen Differentialblutbildes angepasst.
Für auftretende Fragen stehen Ihnen folgende Ansprechpartner/innen gerne zur Verfügung:
Dr. rer. nat. Sylvia Schön (Tel. 05222 8076-159)
Fabian Cuypers (Tel. 05222 8076-561)
Tatjana Tischler (Tel. 05222 8076-267)
Stefanie Rieke (Tel. 05222 8076-195)
Mit freundlichen Grüßen
Ihr Labor Krone