Nach aktuellen Daten der WHO gehört die Gonorrhö weltweit zur dritthäufigsten sexuell übertragbaren Erkrankung (STI). Verlässliche epidemiologische Daten aus Deutschland liegen leider nicht vor, da für die Infektion mit Gonokokken keine Meldepflicht besteht. Zusätzlich wird weltweit eine Resistenzzunahme beobachtet. Zur Erhebung valider Daten bezüglich der Resistenzlage deutschlandweit wurde 2013 das GORENET-Projekt ins Leben gerufen, an dem das Labor Krone
teilnimmt.
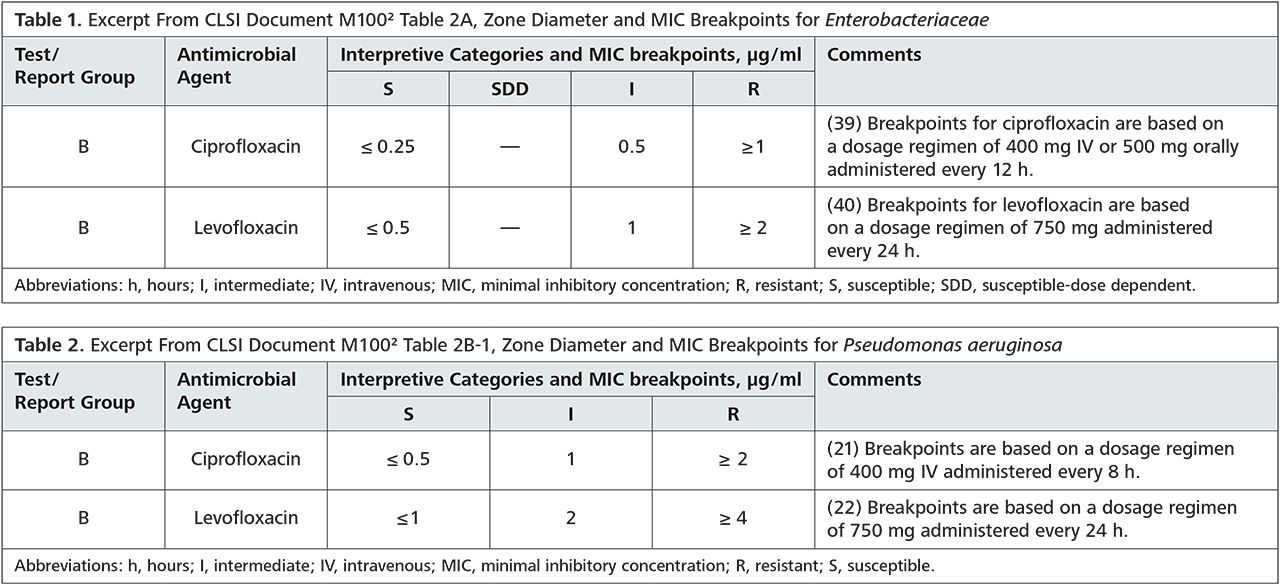
In Anbetracht der Resistenzlage in unserer Region kann zur empirischen Therapie der Empfehlung der S2k-Leitlinie gefolgt werden: In unseren Einsendungen liegt die Sensibilität für Ceftriaxon bei 100% (nur OWL 100%) und für Azithromycin bei 88% (nur OWL 93%). Anzumerken ist, dass die Azithromycingabe bei der empirischen Behandlung eher auf die Koinfektion mit Chlamydien zielt.
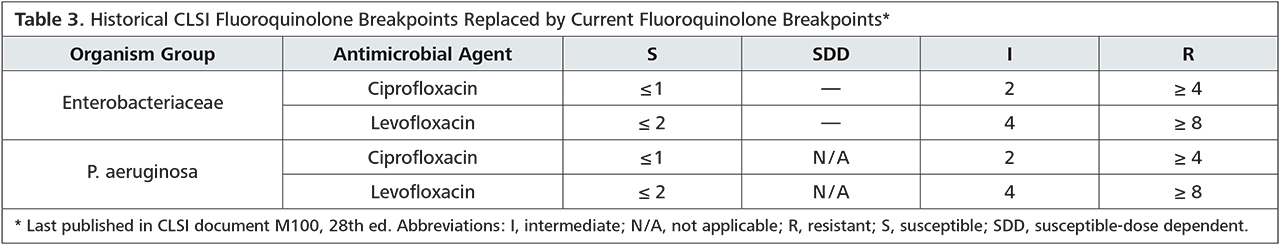
Eine alternative Ciprofloxacintherapie sollte nur nach vorheriger Testung erfolgen, da die aktuelle Resistenzlage für eine empirische Therapie nicht ausreichend ist. Die genaue Resistenzlage ist in der Tabelle aufgeführt.
Fazit: Die leitliniengerechte empirische Therapie mit Ceftriaxon und Azithromycin ist in unserer Region zu empfehlen. Vor Therapiebeginn sollte Diagnostik mittels Abstrichen auf Gonokokken-PCR und Gonokokkenkultur (Cave: verschiedene Abstrichbestecke!) erfolgen. Der Erreger-Nachweis mittels PCR ist sensitiver als die Kultur, jedoch ist eine Resistenztestung nur bei kulturell anzüchtbaren Erregern möglich. Die Therapiekontrolle kann unter Berücksichtigung klinischer Aspekte erfolgen, ggf. kann ein Abstrich zur Gonokokkenkultur nach 3 – 7 Tagen nach Therapieende entnommen werden. Eine Untersuchung mittels PCR ist erst nach mind. 2 Wochen nach Therapieende sinnvoll, da sonst avitale Erreger nachgewiesen werden könnten. Eine Partnertherapie sollte erfolgen!
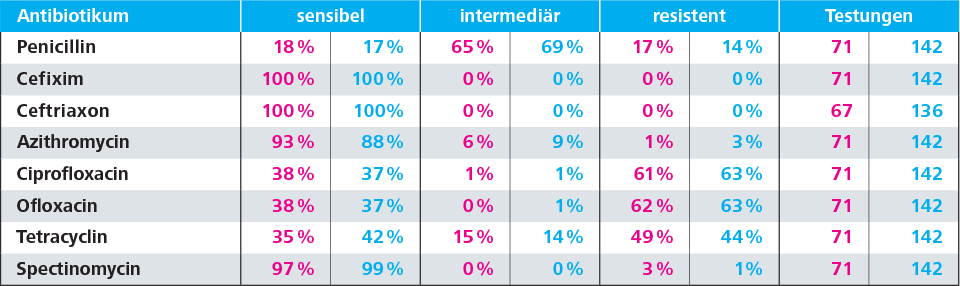
Resistenzen für N. gonorrhoeae in OWL, bzw. Gesamteinsendungen Labor Krone, Zeitraum: 01.01.2016 – 31.12.2018
Für weitere Rückfragen stehen wir gern zur Verfügung:
Abteilung Mikrobiologie
Dr. med. Patricia Wehmeier, Dipl.-Biol. Andreas Groß, Telefon 05222 8076-0